Penjelasan tentang Gaya Antarmolekul
Kehidupan di dunia tidak akan terlepas dari ikatan. Coba bayangkan dapatkah kalian hidup sendirian tanpa teman? Rasanya sangat sulit bukan? Semua makhluk selalu ingin berikatan. Manusia hidup dengan menjalin berbagai ikatan, mulai dari ikatan perkawinan berdasarkan perbedaan jenis kelamin. Kemudian ikatan lebih lanjut mulai dari satu keluarga, satu rukun tetangga (RT), rukun warga (RW), sampai ikatan yang lebih besar dengan berbagai tujuan.
Demikian pula halnya dengan atom dan molekul yang merupakan benda mati itupun tidak luput dari ikatan. Ikatan yang terjadi antaratom beraneka ragam, mulai dari ikatan karena perbedaan muatan (positif negatif), ikatan karena gaya berdasarkan gaya tarik-menarik dipol-dipol sesaat, ikatan yang membentuk jembatan hidrogen, dan ikatan-ikatan yang lain.
Kenyataan di alam sangat jarang ditemukan atom dalam bentuk bebas. Atom-atom dalam bentuk bebas hanya ditemui pada suhu relatif tinggi. Agar menjadi stabil, atom-atom akan saling membentuk kelompok atom (misalnya O2 , H2) atau membentuk molekul (CH4, H2O). Atom yang membentuk molekul akan mempunyai sifat jauh berbeda dengan atom-atom asalnya. Pada setiap molekul terdapat gaya tarik-menarik antaratom. Gaya tarik-menarik antaratom dalam molekul dinamakan ikatan kimia.
Gaya tarik-menarik antarmolekul, yaitu gaya yang menyebabkan antarmolekul menjadi terikat dalam satu kelompok atau merupakan interaksi antara molekul-molekul dalam suatu zat (unsur atau senyawa) melalui gaya elektrostatis. Gaya antarmolekul ini sangat dipengaruhi kepolaran dari masing- masing molekul. Gaya tarik-menarik antarmolekul sangat berkaitan dengan sifat fisika dari senyawa yang bersangkutan.
Beberapa sifat fisika dari senyawa antara lain titik didih, titik beku, kelarutan, kerapatan, tekanan uap, dan tekanan osmosis.
1. Gaya tarik-menarik dipol sesaat-dipol terimbas (gaya London)
Elektron akan senantiasa bergerak dalam orbital. Perpindahan elektron dari satu orbital ke orbital lain mengakibatkan suatu molekul yang tadinya bersifat nonpolar dapat menjadi polar. Sehingga timbul dipol (polar) sesaat. Dipol tersebut disebut sesaat karena dapat berubah jutaan kali setiap detiknya. Hal ini disebabkan adanya tarikan antara elektron satu molekul dan inti molekul lain.
Suatu getaran dalam sebuah molekul mengimbas suatu geseran dalam elektron-elektron molekul tetangga. Tarikan lemah ini pertama kali diuraikan oleh ilmuwan fisika, berasal dari Jerman, Fritz London (dikenal London), pada tahun 1930-an sehingga sering disebut gaya London. Mekanismenya terlihat seperti gambar di bawah ini.

Mekanisme terjadinya gaya London.
Berdasarkan gambar di atas dapat dijelaskan sebagai berikut.
- Molekul nonpolar mempunyai sebaran muatan lautan elektron setimbang dan simetris dalam keadaan normal, elektron terdistribusi merata dalam molekul.
- Pada waktu-waktu tertentu (sesaat) dapat terjadi pengutuban atau pembentukan dipol yang disebut dipol sesaat.
- Sisi bermuatan parsial negatif dari dipol sesaat akan mempengaruhi kerapatan elektron molekul terdekat sehingga membentuk dipol, hal ini memungkinkan dua molekul membentuk ikatan yang disebut gaya London.
- Gaya tarik-menarik ini hanya berlangsung sesaat, dikarenakan dipol sesaat dan terimbas muncul mengikuti fluktuasi elektron.
Molekul mempunyai sifat polarisabilitas berbeda-beda. Polarisabilitas merupakan kemudahan suatu molekul untuk membentuk dipol sesaat atau mengimbas suatu dipol. Polarisabilitas sangat erat hubungannya dengan massa relatif molekul. Pada umumnya molekul dengan jumlah elektron yang besar akan lebih mudah mengalami polarisabilitas. Jika semakin besar nomor massa molekul relatif, maka semakin kuat pula gaya London yang bekerja pada molekul itu. Misal, dua molekul propana saling menarik dengan kuat dibandingkan dua molekul metana. Molekul dengan distribusi elektron besar lebih kuat saling menarik daripada molekul yang elektronnya kuat terikat. Misal molekul I2 akan saling tarik-menarik lebih kuat daripada molekul F2 yang lebih kecil.
Dengan demikian titik didih I2 akan lebih besar jika dibandingkan dengan titik didih F2. Molekul yang mempunyai bentuk molekul panjang lebih mudah mengalami polarisabilitas dibandingkan dengan molekul dengan bentuk simetris. Misal deretan hidrokarbon dengan rantai cabang akan mempunyai titik didih lebih rendah jika dibandingkan dengan hidrokarbon dengan rantai lurus. Normal butana mempunyai titik didih lebih tinggi dibandingkan isobutana yang memiliki rantai cabang.
2. Gaya tarik-menarik dipol-dipol
Molekul dengan sebaran elektron tidak simetris akan bersifat polar. Molekul ini akan memiliki perbedaan muatan (dipol) yang menyebabkan bersifat polar. Molekul yang mempunyai momen dipol permanen disebut polar. Sedangkan senylautanya dinamakan senyawa polar. Molekul-molekul yang ada di dalam senyawa polar cenderung untuk menyusun diri sehingga ujung yang berbeda muatan akan saling mendekat dan saling tarik-menarik. Gaya tarik-menarik dipol-dipol merupakan gaya tarik-menarik antara dua molekul polar. Dipol-dipol molekul tersebut akan saling tarik pada kutub-kutub dengan muatan berllautanan, yaitu positif dan negatif.
Kekuatan tarikan yang timbul akan lebih besar daripada tarikan pada molekul nonpolar. Jadi, zat-zat yang mempunyai molekul- molekul polar cenderung memiliki titik didih dan titik leleh lebih tinggi daripada molekul nonpolar dengan ukuran sama.

Bagan gaya tarik dipol-dipol suatu senyawa.
Gaya antarmolekul, seperti gaya London dan gaya tarik dipol-dipol, secara bersama-sama sering disebut sebagai gaya Van der Waals . Gaya London terdapat pada setiap zat, baik bersifat polar maupun nonpolar. Sedangkan gaya tarik dipol- dipol hanya terdapat dalam senyawa polar. Dalam hal ini, gaya Van der waals juga memiliki peran cukup penting. Karena dalam membandingkan titik didih atau sifat fisika lainnya tidak dapat hanya dilihat dari satu sisi, gaya tarik dipol sesaat-dipol terimbas atau gaya tarik menarik dipol-dipol. Gaya London lebih dominan daripada dipol-dipol.
Contoh
Jelaskan mana yang lebih besar titik didihnya HI atau HCl?
Jawab:
HCl mempunyai momen dipol 1,08 lebih polar jika dibandingkan dengan HI (0,38). Kenyataan HI mempunyai titik didih lebih tinggi dibandingkan HCl, mengapa? Jika ditinjau dari massa molekul relatif, maka massa molekul relatif HCl (Mr = 35,5) lebih kecil dari HI (Mr = 127,9). Oleh karena itu, massa HI lebih besar dari HCl sehingga gaya London HI lebih kuat dari HCl. Dengan demikian, gaya Van der Waal HI lebih besar daripada Hcl
Contoh lain CO2 dan H2O. Karbon dioksida, CO2bersifat karakteristik dari molekul-molekul di mana momen ikatan saling mematikan. Artinya momen dipol (total dipol) molekul tersebut sama dengan 0. Walaupun ikatan kovalen dalam molekul tersebut, C = O, bersifat polar, penataan yang simetris dari ikatan menyebabkan momen-momen ikatan saling meniadakan dan molekul keseluruhan bersifat nonpolar.
Dari rumus senyawa larutanya saja, dapat diduga bahwa molekul H2O akan analog dengan molekul CO2 . Tetapi pada kenyataannya, H2O mempunyai momen dipol yang cukup besar. Selain itu, H2O memiliki domain elektron bebas dan membentuk sudut sehingga molekul H2O bersifat polar. Untuk lebih jelasnya, perhatikan gambar di bawah ini.
Bentuk molekul H2O dan CO2.
3. Ikatan hidrogen
Ikatan hidrogen merupakan gaya tarik-menarik dipol-dipol dengan kekuatan besar (sekitar 5-10 kali lebih besar). Ikatan ini terjadi jika molekul polar mengandung satu atom hidrogen terikat pada atom yang sangat elektronegatif seperti F, O, dan N. Ikatan kovalen polar antara hidrogen dan salah satu atom itu akan terpolarisasi dan tarikan antara molekul-molekul itu cukup kuat. Besar energi ikatannya sekitar 13-30 kJ mol–1 .
Atom-atom yang dapat membentuk ikatan hidrogen adalah N dalam NH3, O dalam H2O, dan F dalam HF. Hal ini dapat dipahami karena ketiga atom tersebut memiliki elektronegativitas yang tertinggi. Perhatikan gambar di bawah ini.

Ikatan hidrogen dalam senyawa H2O dan HF. Tanda ... menunjukkan ikatan hidrogen.
Pada umumnya terdapat hubungan antara titik didih suatu senyawa dengan massa molekul relatifnya. Titik didih akan naik jika massa molekul relatif juga naik, kecuali HF, H2O, dan NH3 . Ketiga senyawa tersebut mempunyai titik didih yang tinggi dibandingkan senyawa lain dalam kelompoknya. Perhatikan Gambar berikut!
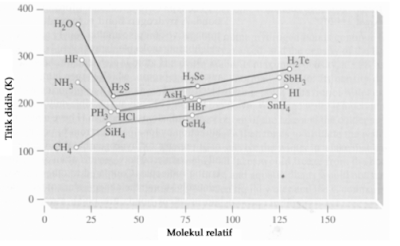
Hubungan titik didih dengan massa molekul.
Fakta tersebut menunjukkan bahwa adanya gaya tarik-menarik antarmolekul HF, H2O, dan NH3 bersifat polar, gaya dipol-dipolnya tidak cukup kuat untuk menerangkan titik didih yang mencolok tersebut.
Peristiwa tersebut menunjukkan adanya ikatan hidrogen pada senyawa itu. Ikatan F-H, O-H, dan N-H bersifat sangat polar, atom H dalam senyawa tersebut sangat positif. Akibatnya atom H dari satu molekul terikat kuat pada atom tetangganya yang memiliki elektronegativitas tinggi.

0 Response to "Penjelasan tentang Gaya Antarmolekul"
Post a Comment