Penjelasan tentang Teori Atom Mekanika Kuantum
Teori Atom Mekanika Kuantum - Kegagalan teori atom Bohr dalam menerangkan spektra atom hidrogen dalam medan magnet dan medan listrik, mendorong Erwin Schrodinger mengembangkan teori atom yang didasarkan pada prinsip- prinsip mekanika kuantum. Teori atom mekanika kuantum mirip dengan yang diajukan oleh model atom Bohr, yaitu atom memiliki inti bermuatan positif dikelilingi oleh elektron-elektron bermuatan negatif. Perbedaannya terletak pada posisi elektron dalam mengelilingi inti atom.
Menurut Bohr, keberadaan elektron-elektron dalam mengelilingi inti atom berada dalam orbit dengan jarak tertentu dari inti atom, yang disebut jari-jari atom (perhatikan Gambar berikut).

Menurut Bohr, jarak elektron dari inti atom hidrogen adalah 0,529Å.
Menurut teori atom mekanika kuantum, posisi elektron dalam mengelilingi inti atom tidak dapat diketahui secara pasti sesuai prinsip ketidakpastian Heisenberg. Oleh karena itu, kebolehjadian (peluang) terbesar ditemukannya elektron berada pada orbit atom tersebut. Dengan kata lain, orbital adalah daerah kebolehjadian terbesar ditemukannya elektron dalam atom.
Menurut model atom mekanika kuantum, gerakan elektron dalam mengelilingi inti atom memiliki sifat dualisme sebagaimana diajukan oleh de Broglie. Oleh karena gerakan elektron dalam mengelilingi inti memiliki sifat seperti gelombang maka persamaan gerak elektron dalam mengelilingi inti harus terkait dengan fungsi gelombang. Dengan kata lain, energi gerak (kinetik) elektron harus diungkapkan dalam bentuk persamaan fungsi gelombang.
Persamaan yang menyatakan gerakan elektron dalam mengelilingi inti atom dihubungkan dengan sifat dualisme materi yang diungkapkan dalam bentuk koordinat Cartesius. Persamaan ini dikenal sebagai persamaan Schrodinger.
Dari persamaan Schrodinger ini dihasilkan tiga bilangan kuantum, yaitu bilangan kuantum utama (n), bilangan kuantum azimut( A ), dan bilangan kuantum magnetik(m). Ketiga bilangan kuantum ini merupakan bilangan bulat sederhana yang menunjukkan peluang adanya elektron di sekeliling inti atom. Penyelesaian persamaan Schrodinger menghasilkan tiga bilangan kuantum. Orbital diturunkan dari persamaan Schrodinger sehingga terdapat hubungan antara orbital dan ketiga bilangan kuantum tersebut.
a. Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) memiliki nilai n = 1, 2, 3, ..., n. Bilangan kuantum ini menyatakan tingkat energi utama elektron dan sebagai ukuran kebolehjadian ditemukannya elektron dari inti atom. Jadi, bilangan kuantum utama serupa dengan tingkat-tingkat energi elektron atau orbit menurut teori atom Bohr. Bilangan kuantum utama merupakan fungsi jarak yang dihitung dari inti atom (sebagai titik nol). Jadi, semakin besar nilai n, semakin jauh jaraknya dari inti.
Oleh karena peluang menemukan elektron dinyatakan dengan orbital maka dapat dikatakan bahwa orbital berada dalam tingkat-tingkat energi sesuai dengan bilangan kuantum utama (n). Pada setiap tingkat energi terdapat
satu atau lebih bentuk orbital. Semua bentuk orbital ini membentuk kulit (shell). Kulit adalah kumpulan bentuk orbital dalam bilangan kuantum utama yang sama.
Kulit-kulit ini diberi lambang mulai dari K, L, M, N, ..., dan seterusnya. Hubungan bilangan kuantum utama dengan lambang kulit sebagai berikut.

Jumlah orbital dalam setiap kulit sama dengan n2 , n adalah bilangan kuantum utama.
b. Bilangan Kuantum Azimut ( l )
Bilangan kuantum azimut disebut juga bilangan kuantum momentum sudut, dilambangkan dengan l . Bilangan kuantum azimut menentukan bentuk orbital. Nilai bilangan kuantum azimut adalah l = n–1. Oleh karena nilai n merupakan bilangan bulat dan terkecil sama dengan satu maka harga l juga merupakan deret bilangan bulat 0, 1, 2, ..., (n–1). Jadi, untuk n=1 hanya ada satu harga bilangan kuantum azimut, yaitu 0. Berarti, pada kulit K (n=1) hanya terdapat satu bentuk orbital. Untuk n=2 ada dua harga bilangan kuantum azimut, yaitu 0 dan 1. Artinya, pada kulit L (n=2) terdapat dua bentuk orbital, yaitu orbital yang memiliki nilai l =0 dan orbital yang memiliki nilai l =1.
Bentuk orbital dengan bilangan kuantum azimut sama dinamakan subkulit. Jadi, bilangan kuantum azimut dapat juga menunjukkan jumlah subkulit dalam setiap kulit. Masing-masing subkulit diberi lambang dengan s, p, d, f, ..., dan seterusnya. Hubungan subkulit dengan lambangnya adalah sebagai berikut.

c. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik disebut juga bilangan kuantum orientasi sebab bilangan kuantum ini menunjukkan orientasi (arah orbital) dalam ruang atau orientasi subkulit dalam kulit. Nilai bilangan kuantum magnetik berupa deret bilangan bulat dari –m melalui nol sampai +m. Untuk l=1, nilai m=0, ±l. Jadi, nilai bilangan kuantum magnetik untuk l=1 adalah –l melalui 0 sampai +l.
Subkulit-s ( l =0) memiliki harga m=0, artinya subkulit-s hanya memiliki satu buah orbital. Oleh karena m=0, orbital-s tidak memiliki orientasi dalam ruang sehingga bentuk orbital-s dikukuhkan berupa bola yang simetris.
Subkulit-p ( l =1) memiliki nilai m= –1, 0, +1. Artinya, subkulit-p memiliki tiga buah orientasi dalam ruang (3 orbital), yaitu orientasi pada sumbu-x dinamakan orbital px, orientasi pada sumbu-y dinamakan orbital py, dan orientasi pada sumbu-z dinamakan orbital pz.
Subkulit-d ( l =2) memiliki harga m= –2, –1, 0, +1, +2. Artinya, subkulit-d memiliki lima buah orientasi dalam ruang (5 orbital), yaitu pada bidang-xy dinamakan orbital dxy , pada bidang-xz dinamakan orbital dxz , pada bidang-yz dinamakan orbital d yz , pada sumbu x2 – y2dinamakan orbital d x2 - y2 , dan orientasi pada sumbu z 2 dinamakan orbital dz 2 . Contoh orientasi orbital dapat dilihat pada Gambar berikut.
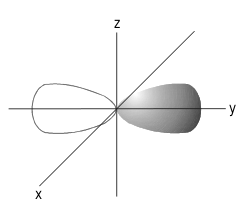
Orientasi orbital pada sumbu y koordinat Cartesius.
d. Bilangan Kuantum Spin (s)
Di samping bilangan kuantum n, A , dan m, masih terdapat satu bilangan kuantum lain. Bilangan kuantum ini dinamakan bilangan kuantum spin, dilambangkan dengan s. Bilangan kuantum ini ditemukan dari hasil pengamatan radiasi uap perak yang dilewatkan melalui medan magnet, oleh Otto Stern dan W. Gerlach.
Pada medan magnet, berkas cahaya dari uap atom perak terurai menjadi dua berkas. Satu berkas membelok ke kutub utara magnet dan satu berkas lagi ke kutub selatan magnet (perhatikan Gambar berikut).

Penguraian berkas uap atom perak (percobaan Stern-Gerlach)
Berdasarkan pengamatan tersebut, disimpulkan bahwa atom-atom perak memiliki sifat magnet. Pengamatan terhadap atom-atom unsur lain, seperti atom Li, Na, Cu, dan Au selalu menghasilkan gejala yang serupa. Atom-atom tersebut memiliki jumlah elektron ganjil. Munculnya sifat magnet dari berkas uap atom disebabkan oleh spin atau putaran elektron pada porosnya.
Berdasarkan percobaan Stern-Gerlach, dapat disimpulkan bahwa ada dua macam spin elektron yang berlawanan arah dan saling meniadakan. Pada atom yang jumlah elektronnya ganjil, terdapat sebuah elektron yang spinnya tidak ada yang meniadakan. Akibatnya, atom tersebut memiliki medan magnet.
Spin elektron dinyatakan dengan bilangan kuantum spin. Bilangan kuantum ini memiliki dua harga yang berlawanan tanda, yaitu + 1/2 dan – 1/2 . Tanda (+) menunjukkan putaran searah jarum jam dan tanda (–) arah sebaliknya (perhatikan Gambar dibawah). Adapun harga, menyatakan fraksi elektron.
Spin elektron dengan arah berlawanan.
Demikianlah materi Kimia tentang Teori Atom Mekanika Kuantum ini saya sampaikan, semoga bermanfaat.

0 Response to "Penjelasan tentang Teori Atom Mekanika Kuantum "
Post a Comment